MODELOS ATOMICOS

Modelo de Thomson

 Modelo de Ruthrford Modelo de Bohr
Modelo de Ruthrford Modelo de Bohr
El modelo atómico de Thomson, también conocido como el modelo del budín, es una teoría sobre la estructura atómica propuesta por Joseph John Thomson, descubridor del electrón, antes del descubrimiento del protón o del neutrón. En dicho modelo, el átomo está compuesto por electrones embebidos en una sopa de carga positiva, como las pasas en un pudín. Se pensaba que los electrones se distribuían uniformemente alrededor del átomo. En otras ocasiones, en lugar de una sopa de carga positiva se postulaba con una nube de carga positiva.
Dicho modelo fue superado tras el experimento de Rutherford, cuando se descubrió el núcleo del átomo. El modelo siguiente fue el modelo atómico de Rutherford.
Dicho modelo fue superado tras el experimento de Rutherford, cuando se descubrió el núcleo del átomo.
Modelo atómico de Rutherford
El modelo atómico de Rutherford, modelo o teoría sobre la estructura del átomo propuesto por el físico Ernest Rutherford, mantenía el planteamiento de Joseph Thomson sobre que los átomos poseen electrones y protones, pero sostenía que todo átomo estaba formado por un núcleo y la corteza. En el núcleo se encontraban reunidas todas las cargas positivas y casi toda la masa y su tamaño sería, en comparación al del átomo, muy pequeño. En la corteza, que rodeaba al núcleo, se encontrarían los electrones describiendo órbitas circulares o elípticas, a gran velocidad (para no caer en él atraídos por su carga eléctrica positiva).
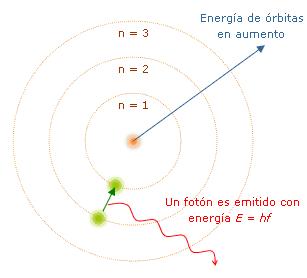
Modelo atómico de Bohr
Niels Bohr se basó en el átomo de hidrógeno para realizar el modelo que lleva su nombre. Bohr intentaba realizar un modelo atómico capaz de explicar la estabilidad de la materia y los espectros de emisión y absorción discretos que se observan en los gases. Describió el átomo de hidrógeno con un protón en el núcleo, y girando a su alrededor un electrón. El modelo atómico de Bohr partía conceptualmente del modelo atómico de Rutherford y de las incipientes ideas sobre cuantización que habían surgido unos años antes con las investigaciones de Max Planck y Albert Einstein. Debido a su simplicidad el modelo de Bohr es todavía utilizado frecuentemente como una simplificación de la estructura de la materia.
Matías L. Dieguez
Curso: 1ero11va
ALGO MAS INTERESANTE
Biografía de Werner K. Heisenberg
Inclinado desde joven por las matemáticas, y en menor medida por la física, intenta en 1920 empezar un doctorado en matemática pura, pero Ferdinand von Lindemann lo rechaza como alumno porque está próximo a jubilarse. Le recomienda hacer sus estudios de doctorado con el físico Arnold Sommerfeld como supervisor, quien lo acepta de buen grado. Tiene como compañero de estudios a Wolfgang Pauli.
Obtiene su doctorado en 1923 y en seguida viaja a Gotinga, donde trabaja como asistente de Max Born. En 1924 viaja a Copenhague y conoce a Niels Bohr. En 1925, Heisenberg inventa la mecánica cuántica matricial. Lo que subyace en su aproximación al tema es un gran pragmatismo. En vez de concentrarse en la evolución de los sistemas físicos de principio a fin, concentra sus esfuerzos en obtener información sabiendo el estado inicial y final del sistema, sin preocuparse demasiado por conocer en forma precisa lo ocurrido en el medio. Concibe la idea de agrupar la información en forma de cuadros de doble entrada.
Fue Max Born quien se dio cuenta de que esa forma de trabajar ya había sido estudiada por los matemáticos y no era otra cosa que la teoría de matrices. Uno de los resultados más llamativos es que la multiplicación de matrices no es conmutativa, por lo que toda asociación de cantidades físicas con matrices tendrá que reflejar este hecho matemático. Esto lleva a Heisenberg a enunciar el Principio de incertidumbre. La teoría cuántica tiene un éxito enorme y logra explicar prácticamente todo el mundo microscópico. En 1932, poco antes de cumplir los 31 años, recibe el premio Nobel de Física por «La creación de la mecánica cuántica, cuyo uso ha conducido, entre otras cosas, al descubrimiento de las formas alotrópicas del hidrógeno».
En 1935 intenta reemplazar a Sommerfeld que se jubila como profesor en Munich, pero los nazis quieren eliminar toda teoría física «judeizante», y en esa categoría entran la mecánica cuántica y la relatividad, cuyos referentes, Max Born y Albert Einstein son judíos, de manera que se impide su nombramiento.
A pesar de esto, en 1938, Heisenberg acepta dirigir el intento nazi por obtener un arma atómica. Durante muchos años subsistió la duda acerca de si este proyecto fracasó por impericia de parte de sus integrantes o porque Heisenberg y sus colaboradores se dieron cuenta de lo que Hitler podría haber hecho con una bomba atómica. Solamente muchos años después, en 1995, se supo que los cálculos alemanes estaban equivocados y que siempre tuvieron la intención de construir la bomba.
Principio de incertidumbre de Heisenberg
Si se preparan varias copias idénticas de un sistema en un estado determinado las medidas de la posición y el momento variarán de acuerdo con una cierta distribución de probabilidad característica del estado cuántico del sistema. Las medidas del objeto observable sufrirá desviación estándar Δx de la posición y el momento Δp verifican entonces el principio de incertidumbre que se expresa matemáticamente como:
Donde h es la constante de Planck (para simplificar,
Curso: 1ero11va


0 Comments:
Post a Comment
<< Home